Viele Patient*innen auf der Intensivstation haben oder entwickeln ein akutes Nierenversagen (AKI). Bisher gibt es keine spezifische Therapie für das AKI, für das keine klar ersichtliche Ursache vorliegt. Unsere (supportiven) Therapieoptionen sind die Optimierung der Hämodynamik und des Flüssigkeitshaushalts und das Vermeiden von nephrotoxischen Substanzen. Bringt das alles nichts, starten wir die Dialyse (Bei Harnstoff über 180 mg/dl? Na dann schaut mal hier: https://kidney-campus.de/mythen-der-nephrologie-ep-2-wir-mussen-den-harnstoff-runterdialysieren/ )
Bei Kreatininanstieg Flüssigkeit anhängen – das ist oft ein Reflex in der Notfall- und Intensivmedizin. Aber gerade bei AKI-Patient*innen kann eine Hypervolämie echt zum Problem werden! Wieso? Zum einen steigt durch Volumenüberladung der systemische Gefäßwiderstand – was die Nachlast erhöht. Dadurch sinkt das Herzminutenvolumen, also -> schlechtere Durchblutung.
Unter normalen Bedingungen ist der Druck in den zentralen Venen niedrig. Durch eine Volumenüberladung steigt dieser allerdings und es entwickelt sich ein interstitielles Ödem – in der Lunge kennen wir das als Lungenödem. In der Niere entwickelt sich ebenfalls ein interstitielles Ödem und dadurch wird die Organfunktion eingeschränkt. (Dies wird übrigens oft als intravasales Volumendefizit trotz Volumenüberladung fehlinterpretiert!). Mehr dazu findet ihr in dieser spannenden Präsentation über Twitter:
Außerdem noch ein kleiner Reminder an dieser Stelle, dass wir einen echten Volumenmangel (Hypovolämie) bei Intensivpatient:innen sehr selten sehen. Wenn der/die Patient:in auf der ITS ankommt, hat er/sie meist schon mind. 1-3l Volumen intus (durch Notärzt:in und Behandlung in der Rettungsstelle).
Es gibt immer mehr Daten, die bei Sepsis und im ARDS zurückhaltende Strategien im Hinblick auf die Flüssigkeitsgabe als sicher und teils sogar mit besseren Outcomes beschreiben. Im AKI gab es bisher eine solche Studie noch nicht – und gerade hier wäre Bedarf einer Antwort auf die Frage: Ist weniger vielleicht mehr?
Um zunächst die Machbarkeit einer Studie, die der Frage näherkommt, zu testen, hat das REVERSE-AKI Study Team jetzt folgendes Paper im Intensive Care Medicine rausgebracht:
“Restrictive fluid management versus usual care in acute kidney injury (REVERSE-AKI): a pilot randomized controlled feasibility trial”
Worum geht’s?
Zur Planung einer Studie zur Beantwortung der Frage, ob eine zurückhaltende Flüssigkeitstherapie in AKI-Patient*innen sicher und möglicherweise sogar besser ist, wurde zunächst die hier vorgestellte Machbarkeitsstudie durchgeführt. Die Hypothese war dabei, dass das restriktive Flüssigkeitsmanagement zu einer „lower cumulative fluid balance“/ geringeren Flüssigkeitsbilanz nach 72h führt.
Methode:
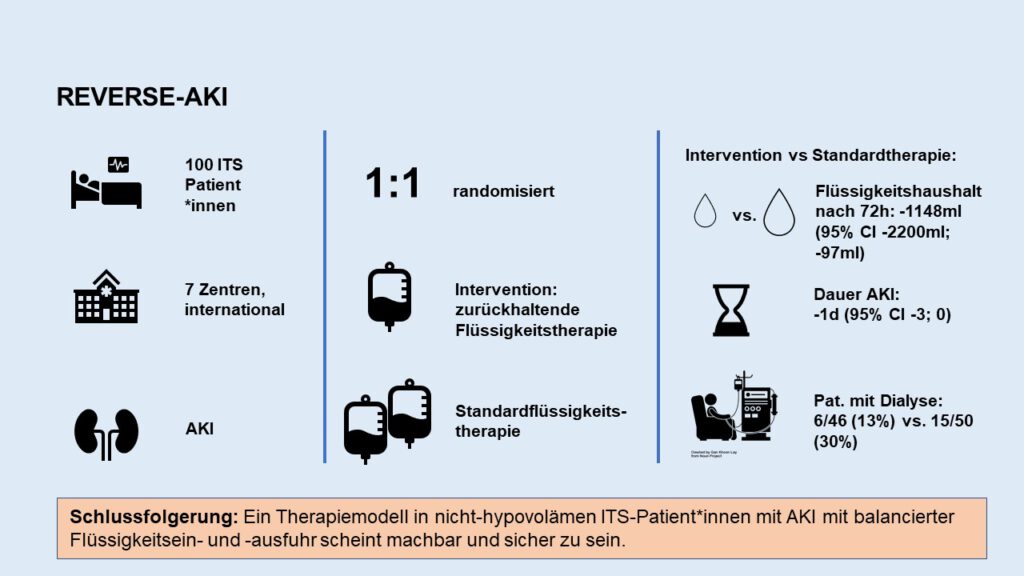
- Mulizentrische, nicht verblindete, randomisierte, kontrollierte Studie in 5 europäischen und 2 australischen Intensivstationen (ITS)
- Die Patient*innen wurden elektronisch 1:1 randomisiert und erhielten entweder die Standardflüssigkeitstherapie oder eine zurückhaltende Flüssigkeitstherapie
- AKI Stadien nach KDIGO und klinische Zeichen einer Volumenüberladung (eindrückbare Ödeme, pO2 / FIO2 Ratio <200 (= moderates ARDS)) dienten zur Stratifizierung
- Wichtig über die Patient*innen zu wissen: seit mind. 12h, aber nicht länger als 72h auf der ITS, hatten ein AKI ohne Dialyse, laut Behandler*in nicht hypovoläm, bleibt noch mind. 48h auf der ITS
- AKI war dabei definiert als i) 1.5-facher oder größerer Kreatininanstieg und/oder ii) weniger als 0.5 ml/kg/h oder 6 ml/kg Urinproduktion innerhalb der letzten 12h
Interventionen in der Gruppe „zurückhaltende Flüssigkeitstherapie“ mit dem Ziel eine negative Flüssigkeitsbilanz zu erreichen:
- Flüssigkeitsgaben nur im Rahmen von Medikamentengaben, zur Ernährung und (falls notwendig) im Rahmen von Blutprodukten
- Zusätzliche Flüssigkeitsgaben nur falls enterale Ernährung nicht toleriert wurde oder kontraindiziert war
- Flüssigkeitsbolus nur wenn klinisch als notwendig erachtet
- Die Urinmenge sollte der Flüssigkeitsgabe angepasst werden, mit dem Ziel einer negativen Flüssigkeitsbilanz
- Wenn das Ziel auf diese Weise nicht erreicht werden konnte, sollte dialysiert werden
In der Standardtherapiegruppe erfolgten Flüssigkeitsgaben so wie in der Routine sonst vorgesehen.
Interventionsdauer war 7 Tage oder Entlassung von der ITS (je nach dem, was zuerst eintrat).
Primäres Outcome war der Flüssigkeitshaushalt / die Flüssigkeitsbilanz 72h nach Randomisierung.
Sekundäre Endpunkte waren I) Dauer des AKI, II) Anzahl an Patient*innen, die dialysiert wurden, III) Flüssigkeitshaushalt nach 24h und zum Verlegungszeitpunkt, IV) Diuretikadosis. Zudem gab es noch weitere explorative Outcomes.
Ergebnisse:
100 Patient*innen wurden analysiert. Die häufigsten Gründe für den ITS-Aufenthalt waren Herzstillstand (8.2%), Septischer Schock (7.2%) und gastrointestinale Blutung / Perforation (7.2%). Das AKI wurde in 55% als “multifaktoriell” gewertet. Die Gruppe mit restriktiver Flüssigkeitstherapie hatte nach 72h eine negative Flüssigkeitsbilanz von -1080ml (Mittelwert, SD 2003 ml) und die Gruppe mit Standardtherapie eine positive Bilanz mit +61 ml (Mittelwert, SD 3131ml). Die Differenz zwischen beiden Gruppen im Hinblick auf den Flüssigkeitshaushalt waren nach 72 Stunden -1148 ml (95% CI: − 2200 bis − 96ml), P = 0.033. Es gab keinen Unterschied im Hinblick auf die Dauer des AKI, jedoch wurden weniger Patient*innen in der Gruppe „zurückhaltende Flüssigkeitstherapie“ dialysiert. 35 Patient*innen (71.4%) in der Gruppe „zurückhaltende Flüssigkeitstherapie“ und 38 Patient*innen (74.5%) in der Standardtherapiegruppe erhielten Diuretika, in der kumulativen Dosis gab es zwischen den Gruppen keinen signifikanten Unterschied. Schwere Nebenwirkungen (breit gestreut, u.a. neue aufgetretenes Vorhofflimmern, Hypokaliämie, zerebrale Ischämie) traten in 6 Patient*innen (12.2%) in der Gruppe mit zurückhaltende Flüssigkeitstherapie auf, in der Standardtherapiegruppe in 16 Patient*innen (31.4%) (RR 0.39; 95% CI 0.15–0.86, P = 0.031). Protokollverstöße traten in 18 Patient*innen (36.7%) im Arm mit zurückhaltender Flüssigkeitstherapie auf und in 5 Patient*innen (9.8%) mit Standardtherapie. Dabei war die Gabe von zusätzlicher Flüssigkeit der am häufigsten zu beobachtende Protokollverstoß.
Diskussion:
In der beschriebenen Machbarkeitsstudie wurde bei 100 ITS-Patient*innen mit AKI untersucht, ob im Vergleich zur Standardflüssigkeitstherapie eine zurückhaltende Flüssigkeitstherapie zu einem bedeutenden Unterschied der Flüssigkeitsbalance nach 72h führt ohne zu schaden. Mittels des eingesetzten Protokolls konnte eine negative Bilanzierung erreicht werden, zudem hatten Patient*innen dieser Gruppe weniger unerwünschte Ereignisse und weniger Patient*innen dieser Gruppe wurden dialysiert. Wenige Studien haben eine balancierte Flüssigkeitstherapie in der besagten Patient*innengruppe bisher analysiert. In der FACTT-Studie (Fluids and Catheters Treatment Trial (FACTT), Studie mit Ziel die optimale Flüssigkeitsmanagement-Strategie bei ARDS herauszufinden, aus 2006 im NEJM https://pubmed.ncbi.nlm.nih.gov/16714767/) war außerdem die Flüssigkeitsbalance auch im Interventionsarm positiv (+150ml versus +5000ml). In Sepsis laufen aktuell ebenfalls die ersten Studien, die einen frühen Vasopressoreinsatz vor Einleitung einer Volumentherapie untersuchen (https://clinicaltrials.gov/ct2/show/NCT03434028). Viele Studien bisher haben nur die Erhöhung des Outputs im Focus gehabt, jedoch nicht, wie in dieser Studie, auch den Input. Daher ist dies die erste Studie, die ein Protokoll mit kombinierten Maßnahmen enthält (Flüssigkeitsein- und -ausfuhr) und eine negative Flüssigkeitsbalance erreicht wird.
Ein Therapiemodell in nicht-hypovolämen ITS-Patient*innen mit balancierter Flüssigkeitsein- und -ausfuhr scheint demnach machbar und sicher zu sein. Hier zeigten sich mehr unerwünschte Events in der Standardtherapiegruppe. Das wirft die Frage auf, ob diese mit den Flüssigkeitsgaben und den zusätzlich durchgeführten Dialysen zusammenhängen.
Stärken der Studie: Randomisiert, multinational, Ein- und Ausfuhr-Interventionen, Betrachtung vieler Nebenwirkungen der reduzierten Flüssigkeitstherapie
Schwächen der Studie: Nicht verblindet, Flüssigkeitshaushaltsbestimmung ist nicht exakt möglich, in der Interventionsgruppe mehr Protokollverletzungen, Patient*innen mit festgelegten Therapieeinschränkungen wurden ausgeschlossen.
Mein Fazit: Interessante und praxisnahe Studie, hat mich angesprochen, weil der Reflex „Krea hoch – Flüssigkeit ran“ so oft zu beobachten ist. Das primäre Outcome, also wieviel weniger Flüssigkeit die Interventionsgruppe nun genau hat, finde ich nicht so spannend. Spannender ist ja, den Einfluss auf das AKI und die Mortalität zu betrachten. Aber klar, es handelt sich hierbei eben um die (kleine) Machbarkeitsstudie, die vor einer großen Studie (die hoffentlich Antworten auf die wichtigen Fragen gibt) nötig ist.
Hier die Originalstudie zum Nachlesen:
