In der Klinik hört man manchmal, dass Ödeme bei Patient:innen durch eine gleichzeitig bestehende Hypalbuminämie erklärt werden – wohlgemerkt auch bei Patient:innen, ohne nephrotisches Syndrom oder Leberzirrhose. Die Patientin hat dann sog. „Hypalbuminämie Ödeme“. Daraus wird dann die therapeutische Konsequenz abgeleitet, Albumin intravenös zu substituieren.
Erklärt wird der o.g. Zusammenhang zwischen Ödemen und der Serum-Albuminkonzentration mit der Starling-Gleichung. Albumin leistet den größten Beitrag zum kolloidosmotischen Druck und entscheidet damit über den intravasalen Füllungszustand. Ein Albuminmangel führt über Reduktion dieses intravasalen kolloidosmotischen Druckes zu einer verminderten Rückresorption von interstitieller Flüssigkeit in den Kapillaren und damit zur Ödembildung. Das nephrotische Syndrom und die Leberzirrhose werden dann als Beispielerkrankungen ins Feld geführt, bei denen die Hypalbuminämie Ödeme auf die o.g. Weise verursacht.
In dieser Ausgabe von „Mythen der Inneren Medizin & Nephrologie“ möchte ich euch darlegen, dass niedrige Serum-Albuminkonzentrationen in der Regel keine Ödeme verursachen und eine Substitution demnach auch nicht sinnvoll ist.
Klären wir zunächst die Frage, wie Ödeme beim nephrotischen Syndrom und Leberzirrhose entstehen, wenn nicht durch den Albuminmangel?
Ödeme bei nephrotischem Syndrom
Das nephrotische Syndrom ist eine Erkrankung, die mit einer massiven Proteinurie, Ödemen und einer Hypoalbuminämie einhergeht (<<15g/dl). Zwischen der Hypalbuminämie und Ödemen eine Kausalverbindung herzustellen liegt nahe. Diese Kausalverbindung stellte auch die sog. „Underfill“ Theorie her (1). Nach dieser Theorie führt der Albuminmangel über den reduzierten kolloidosmotischen Druck zu einem intravasalen Volumenmangel (= Underfill), der wiederum eine Aktivierung des Renin-Angiotensin Systems bedingt. Über die RAS Aktivierung wird Salz und Wasser retiniert, welches die Ödeme unterhält, da dieses Volumen nicht intravasal gehalten werden kann.
Mittlerweile wird die “Underfill”- Theorie, von der sog. „Overfill“ Theorie ergänzt (2). Die Overfill-Theorie besagt, dass die erkrankte nephrotische Niere durch Störung des tubulären Salz- und Wasserhandlings für die Natriumretention verantwortlich ist. Bei Nagern mit experimentellem nephrotischen Syndrom fand sich eine Aktivierung des epithelialen Natriumkanals ENaC im distalen Tubulus, und eine ENaC-blockierende Behandlung mit Amilorid verhinderte die Ödembildung in Gänze (3,4). Diese ENaC-Aktivierung beruht auf der Proteolyse der Porenregion durch Serinproteasen (5) . Aktuelle Arbeiten weisen aus, dass der ENaC beim nephrotischen Syndrom durch die aberrante Filtration von Plasma-Serinproteasen im Sinne einer Proteasurie „fälschlicherweise“ proteolytisch aktiviert wird (6). Behandlung von nephrotischen Mäusen mit dem Serinprotease-Hemmstoff Aprotinin verhindert die ENaC-Aktivierung und Ödembildung ohne die Proteinurie zu senken. Damit ist die Proteasurie ein spezieller qualitativer Aspekt des Urins, der über die Ödembildung entscheidet. Die genaue Identität der an der ENaC-Aktivierung beteiligten Serinproteasen beim nephrotischen Syndrom wird intensiv erforscht.
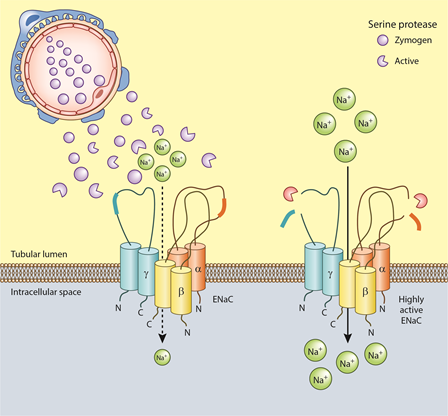
Abbildung 1. Modell der ENaC-Überaktivierung durch Proteasurie beim nephrotischen Syndrom (Quelle (5)).
Durch das erkrankte Glomerulus kommt es zu einer aberranten Fitlration von großmolekularen Serinproteasen aus dem Plasma, die im Tubulusraum aktiviert werden und ENaC durch Herausschneiden von kurzen Peptidketten an der α- und γ-Untereinheit aktivieren können. Die Identität der beteiligten Serinprotease(n) ist noch unbekannt und Gegenstand aktueller Forschung
Ödeme bei Leberzirrhose
Bei der Leberzirrhose wurden die Ödeme durch eine RAS-Aktivierung infolge eines intravasalen Volumenmangel bei Albuminmangel erklärt. Die aktuelle Lehrmeinung – auch hier nur sehr verkürzt dargestellt – geht davon aus, dass vasodilatative Substanzen aus dem Splanchnikusgebiet eine systemische Vasodilatation auslösen (7). Der Pathomechanismus ähnelt dem eines vasodilatorischen Schocks. Über ein niedriges effektiv zirkulierende Blutvolumen kommt es zu einer RAS-Aktivierung und ADH-Ausschüttung, wozu es zur renalen Wasser- und Natriumretention kommt. Insgesamt liegt bei der Leberzirrhose ein Underfill vor. Aggraviert wird dieser durch die Aszitesbildung, die auf der portalen Hypertension infolge eines erhöhten hepatischen Widerstands durch Fibrose beruht. Dabei wird ein proteinreiches Transsudat von der Leberoberfläche in die Bauchhöhle abgepresst. Das ergibt das Bild einer „weinenden Leber“.
Warum führt Hypalbuminämie nicht zu Ödemen?
Warum führt aber eine Hypalbuminämie nicht zu Ödemen, wie es die Starling-Gleichung doch so logisch erscheinen lässt? Die Erklärung dafür ist wahrscheinlich, dass die Hypalbuminämie gar nicht zu einem Gradienten des kolloidosmotischen Drucks zwischen intravasal und interstitiell führt. Denn tatsächlich befinden sich nur 40% des Körperalbumin intravasal, die restlichen 60% im Interstitium. Ein Albuminmangel reduziert intravasale und interstitielle Konzentration gleichermaßen und somit wird auch der kolloidosmotische Druck gleichermaßen reduziert (Abbildung 1), sodass sich kein positiver Druckgradient aufbaut. Dafür gibt es reichlich experimentelle Evidenz aus Tiermodellen und aus Studien an Patient:innen mit nephrotischem Syndrom (8–10).
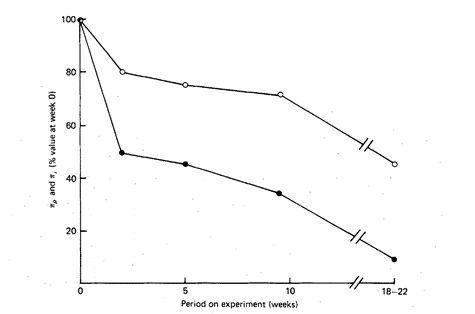
Abbildung 2: Plasma kolloidosmotischer Druck (π) (○); und interstitieller kolloidosmotischer Druck ( ● ) , angegeben in % des Ausgangswert der Woche 0 bei Ratten, die mit einer „Low protein“ Diät gefüttert wurden. Quelle (8).
Im Übrigen finden sich in Fallserien mit Patient:innen mit kongenitaler Analbuminämie bei knapp 50% gar keine Ödeme, bei der anderen Hälfte nur leichte Knöchelödeme (11). Einschränkend muss gesagt werden, dass ein sehr schnelles Absinken der Serum-Albuminkonzentration möglicherweise zu Ödemen führen kann. Dies ist wahrscheinlich bei der Minimal Change Erkrankung bei Kindern der Fall und auch dafür gibt es tierexperimentelle Evidenz (2). Hier kommt dann auch ein Underfill zum Tragen, so dass die diuretische Therapie vorsichtig gehandhabt werden muss.
Ein integrativer Erklärungsansatz zur Ödementstehung beim nephrotischen Syndrom vereint die Underfill- und Overfill-Theorie (6).
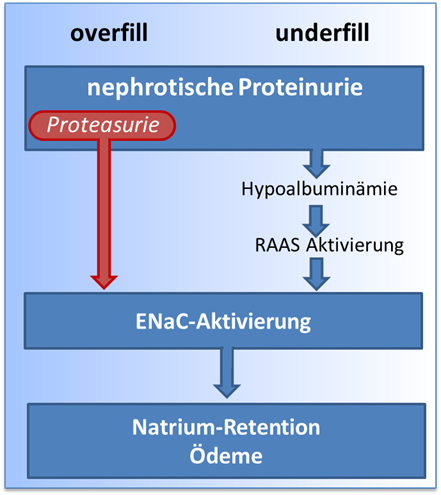
Die Proteasurie als Teil der Proteinurie führt zu einer primären ENaC-Aktivierung im Sinne der Overfill-Theorie und kann bei schwerer Hypoalbuminämie durch einen Underfill überlagert werden. Beide Ansätze münden gemeinsam in eine ENaC-mediierte vermittelte renale Natrium-Retention und Ödemen.
Take home messages:
- Hypalbuminämie verursacht in der Regel keine Ödeme, da sie den kolloidosmotischen Druck in den Kapillaren und im Interstitium gleichermaßen reduziert und sich kein Druckgradient aufbauen kann.
- Albumininfusionen zur Therapie von Ödemen sind beim nephrotischen Syndrom nicht effektiv, bei Leberzirrhose mit hepatorenalem Syndrom jedoch indiziert
- Beim nephrotischen Syndrom werden die Ödeme nicht durch Hypalbuminämie verursacht, sondern, gemäß der „Overfill“-Theorie, durch eine Aktivierung des ENaC im Rahmen der Proteasurie.
- Bei der Leberzirrhose werden die Ödeme durch eine renale Natriumretention infolge eines niedrigen effektiven zirkulierendes Blutvolumen mit konsekutiver RAS Aktivierung in Verbindung mit der portalen Hypertension und Aszitesbildung ausgelöst (underfill).
Dieser Artikel wurde freundlicherweise reviewed durch Prof. Dr. med. Ferruh Artunc, Oberarzt, Nephrologie der Medizinischen Klinik IV, Universitätsklinikum Tübingen.
Quellen:
1. Gupta S, Pepper RJ, Ashman N, Walsh SB. Nephrotic Syndrome: Oedema Formation and Its Treatment With Diuretics. Front. Physiol. 2018;91868. doi:10.3389/fphys.2018.01868 Cited in: PubMed; PMID 30697163.
2. Siddall EC, Radhakrishnan J. The pathophysiology of edema formation in the nephrotic syndrome. Kidney International. 2012;82(6):635–42. doi:10.1038/ki.2012.180 Cited in: PubMed; PMID 22718186.
3. Deschênes G, Wittner M, Di Stefano A, Jounier S, Doucet A. Collecting duct is a site of sodium retention in PAN nephrosis: a rationale for amiloride therapy. Journal of the American Society of Nephrology: JASN. 2001;12(3):598–601. doi:10.1681/ASN.V123598 Cited in: PubMed; PMID 11181809.
4. Bohnert BN, Daiminger S, Wörn M, Sure F, Staudner T, Ilyaskin AV, Batbouta F, Janessa A, Schneider JC, Essigke D, Kanse S, Haerteis S, Korbmacher C, Artunc F. Urokinase-type plasminogen activator (uPA) is not essential for epithelial sodium channel (ENaC)-mediated sodium retention in experimental nephrotic syndrome. Acta Physiologica. 2019;227(4):e13286. doi:10.1111/apha.13286 Cited in: PubMed; PMID 31006168.
5. Bohnert BN, Essigke D, Janessa A, Schneider JC, Wörn M, Kalo MZ, Xiao M, Kong L, Omage K, Hennenlotter J, Amend B, Birkenfeld AL, Artunc F. Experimental nephrotic syndrome leads to proteolytic activation of the epithelial Na+ channel in the mouse kidney. American journal of physiology. Renal physiology. 2021;321(4):F480-F493. doi:10.1152/ajprenal.00199.2021 Cited in: PubMed; PMID 34423678.
6. Artunc F, Wörn M, Schork A, Bohnert BN. Proteasuria-The impact of active urinary proteases on sodium retention in nephrotic syndrome. Acta Physiologica. 2019;225(4):e13249. doi:10.1111/apha.13249 Cited in: PubMed; PMID 30597733.
7. Engelmann C, Clària J, Szabo G, Bosch J, Bernardi M. Pathophysiology of decompensated cirrhosis: Portal hypertension, circulatory dysfunction, inflammation, metabolism and mitochondrial dysfunction. Journal of Hepatology. 2021;75 Suppl 1S49-S66. doi:10.1016/j.jhep.2021.01.002 Cited in: PubMed; PMID 34039492.
8. Joles JA, Willekes-Koolschijn N, Braam B, Kortlandt W, Koomans HA, Dorhout Mees EJ. Colloid osmotic pressure in young analbuminemic rats. The American journal of physiology. 1989;257(1 Pt 2):F23-8. doi:10.1152/ajprenal.1989.257.1.F23 Cited in: PubMed; PMID 2750922.
9. Koomans HA, Geers AB, Dorhout Mees EJ, Kortlandt W. Lowered tissue-fluid oncotic pressure protects the blood volume in the nephrotic syndrome. NEF. 1986;42(4):317–22. doi:10.1159/000183695 Cited in: PubMed; PMID 3960243.
10. Koomans HA, Kortlandt W, Geers AB, Dorhout Mees EJ. Lowered protein content of tissue fluid in patients with the nephrotic syndrome: observations during disease and recovery. NEF. 1985;40(4):391–5. doi:10.1159/000183505 Cited in: PubMed; PMID 4022206. 11. Russi E, Weigand K. Analbuminemia. Klinische Wochenschrift. 1983;61(11):541–5. doi:10.1007/BF01486843
Cited in: PubMed; PMID 6348399
