In dieser Episode “Mythen der Nephrologie & Inneren Medizin” widmen wir uns der Praxis, Thiazide – vor allem Xipamid wird hier genutzt- zur Therapie einer Hypernatriämie auf der Intensivstation einzusetzen.
Übrigens: Wer noch glaubt, dass Xipamid eine Sonderstellung unter den Thiaziddiuretika besitzt und als einziges bei deutlich eingeschränkter Nierenfunktion wirkt, den verweisen wir auf Episode 1 dieser Reihe.
Hypernatriämie (= Serum-Natrium > 145 mmol/l) ist ein häufiges Problem auf der Intensivstation (= ICU acquired Hypernatremia) und tritt bei 7-9% aller Intensivpatient*innen auf (1). Sie ist stets mit einer Hyperosmolarität des extrazellulären Volumens (EZV) verbunden und tritt vor allem bei sedierten Patient*innen auf, die ihre Trinkmenge nicht selbstständig regulieren können.
Ihre Genese ist multifaktoriell bedingt: 1) Verlust an Wasser, z.B. Diarrhoe, Erbrechen, exzessives Schwitzen, Diuretika, Diabetes insipidus; 2) reduzierte Aufnahme z.B. alteriertes Durstgefühl bei Demenz, ungenügende Zugangsmöglichkeit; 3) exzessive Salzbeladung, wie z.B. bei Infusionen mit hypertoner Kochsalzlösung oder Therapie mit Natriumbicarbonat
Grundsätzlich kann man eine Hypernatriämie bei Hypovolämie (z.B. renale Verluste (Urin-Na > 20 mmol/l), gastrointestinale Verluste (Urin-Na < 10 mmol/l)), bei Euvolämie (z.B. Diabetes insipidus, hypothalamische Erkrankungen) und bei Hypervolämie (z.B. Therapie mit hypertonen NaCl-Lösungen, Natriumbicarbonat-Infusionen, primärer Hyperaldosteronismus) unterscheiden.
Die Hypernatriämie sollte korrigiert werden, da sie mit einem starken Durstgefühl einhergeht und damit Stress auslöst. Darüber hinaus kann eine Hypernatriämie ein Delir begünstigen und ist mit einer erhöhten Mortalität assoziiert. Im Allgemeinen sind kausale Ursachen primär zu adressieren, wie z.B. Reduktion gastrointestinaler Wasserverluste, Fiebersenkung.
Vielerorts auf Intensivstationen werden Thiazide eingesetzt, um unterschiedliche Formen der Hypernatriämie zu korrigieren. Warum Thiazide aus meiner Sicht grundsätzlich nicht zur Therapie der Hypernatriämie geeignet sind, möchte ich euch im Folgenden darlegen:
Thiazide bei Hypernatriämie einzusetzen, erscheint zunächst plausibel, da Thiazide den Natrium/Chlorid Cotransporter (NCC) im distalen Tubulus hemmen und es hierdurch zu einer vermehrten Natriumausscheidung (+Wasserausscheidung) kommt. Außerdem ist aus der Bluthochdrucktherapie bekannt, dass Thiazide bei einem Teil der Patient*innen als Nebenwirkung Hyponatriämien auslösen (Thiazide induced Hyponatremia = TIH) können. Insofern könnte man mutmaßen, dass Thiazide eine Hypernatriämie zu einer „Eunatriämie“ korrigieren könnten.
Zunächst eine Klarstellung zum Mechanismus der Thiazid-induzierten Hyponatriämie:
Tatsächlich wird diese nicht durch eine vermehrte Natriumausscheidung bedingt, wie man vom Wirkmechanismus her schlussfolgern könnte, sondern durch eine Verdünnung des Serumnatriums durch eine Kombination von vermehrtem Trinken und gestörter Ausscheidung von freiem Wasser. In Studien mit Patient*innen mit TIH ließ sich nach kontrollierter Re-exposition sowohl eine gesteigerte Trinkmenge (2.5L vs 1.8L pro Tag) als auch eine Gewichtszunahme (+0.85kg) und eine inadäquat hohe Urinosmolarität nachweisen (2,3). Die Kombination von hoher Urinosmolarität und Gewichtszunahme zeigen dabei auf eine gestörte Ausscheidung von freiem Wasser an. Bei den gesunden Kontrollpatient*innen kam es dagegen zu einer Gewichtsabnahme (-0.47kg) und einem nur minimal gesunkenem Plasmanatrium (-1.2mmol/l +-0,4mmol/l). Wie es unter Thiaziden zu dieser Störung der Ausscheidung von freiem Wasser kommt, ist nicht sicher geklärt.
Man weiß, dass ungefähr 50 Prozent der Patient*innen mit TIH einen single-nucleotide Polymorphismus in einem Gen tragen, das für einen Prostaglandin Transporter (PGT) im Sammelrohr kodiert (4). Dieser Transporter vermittelt den Transport von luminalem Prostaglandin E2 (PGE2) auf die basolaterale Seite (Abbildung 1). Dort, basolateral, hemmt PGE2 den Einbau von Aquaporinen in die Zellmembran. In Patient*innen mit diesem Polymorphismus ist die Transporterfunktion verringert, sodass es zu erhöhten luminalen Prostaglandin E2 Leveln kommt. Anders als auf der basolateralen Seite führt PGE2 auf der luminalen Seite über einen anderen Rezeptor (EP4) zu einem vermehrten Einbau von Aquaporin 2 und damit zu einer höheren Wasserresorption. Die Theorie ist, dass dieser Polymorphismus nur relevant wird, wenn insgesamt mehr Prostaglandin E2 anfällt. Es wird gemutmaßt, dass Thiazide eine erhöhte PGE2 Synthese bedingen könnten.
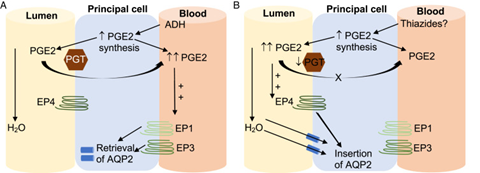
Zusammengefasst: Hyponatriämie unter Thiaziden wird durch eine Kombination von vermehrtem Trinken und verringerter Ausscheidung von freiem Wasser bei wahrscheinlich genetisch suszeptiblen Patient*innen ausgelöst (5). Bei der Mehrzahl der Patient*innen hat eine Thiazidtherapie keinen, bzw. kaum einen Einfluss auf das Plasmanatrium.
Neben dieser theoretischen Überlegung gegen den Einsatz von Thiaziden zur Therapie der ICU acquired Hypernatriämie gibt es außerdem eine randomisierte placebokontrollierte Studie, die diese Fragestellung untersucht hat (6):
In dieser Studie wurden 50 Patient*innen mit einer auf der Intensivstation erworbenen Hypernatriämie (Na >143mm/l) zu HCT oder zu Placebo randomisiert. Dabei wurden 1x täglich 25mg HCT bis zu 7 Tage gegeben. In der Studie zeigte sich kein Unterschied im Abfall der Plasmanatriumkonzentration zwischen den Gruppen, ebenso nicht im Anstieg der Urinnatriumkonzentration. In beiden Gruppen fiel das Natrium im Median um 4mmol/l. Die Autor*innen selbst diskutieren, dass die Dosis von 25mg möglicherweise nicht ausgereicht habe. Dies ist allerdings die Dosis, die in der klinischen Praxis auf der Intensivstation immer wieder verschrieben wird. Darüber hinaus zeigte sich in pharmakologischen Studien, die verschiedene HCT Dosen (25, 50, 100mg) verglichen, keine höhere Urinelektrolytexkretion bei Dosen über 25mg (7). Ähnliches wurde auch für Xipamid gezeigt. Bei gesunden Proband*innen wurde die maximale Wirkung bereits bei 5mg erreicht (8)
Was sollte man stattdessen zur Korrektur der Hypernatriämie tun?
Primär sollte man die Ursachen adressieren, indem man z.B. Hypernatriämie auslösende Medikamente beendet, oder die Natriumbelastung reduziert, z.B. durch einen Wechsel der Infusionsträger von NaCl auf Glukoselösung (falls möglich!).
Aus meiner Sicht sollte dann eine Hypernatriämie auf der Intensivstation durch die Gabe von freiem Wasser korrigiert werden, vorzugsweise über eine enterale Gabe, ggf auch in Form von Wasser-/Teegabe via Magensonde bei beispielsweise intubierten/beatmeten Patient*innen Falls eine enterale Gabe nicht möglich ist, sollte die Gabe von Glukoselösung (5%ig) erfolgen. Der Bedarf an freiem Wasser, um eine Hypernatriämie auszugleichen, sollte stets im Vorfeld, z.B. mit einem Onlinerechner ausgerechnet werden.
Ein großes Caveat gibt es! Eine große Hürde für die Korrektur ist die Einhaltung des Bilanzziels. In die Gesamtbilanz eines Patienten geht freies Wasser (somit auch G5% Lösung) zu 100% ein, genauso wie Vollelektrolytlösung. Das führt dazu, dass die freien Wassergaben die Bilanzziele sprengen. Der Hypernatriämieausgleich scheitert dann daran, dass die Behandelnden die Positivbilanz fürchten. Gerade bei beatmeten Patient*innen wird versucht, eine positive Bilanz zu vermeiden, um den Gasaustausch nicht durch ein Lungenödem zu verschlechtern.
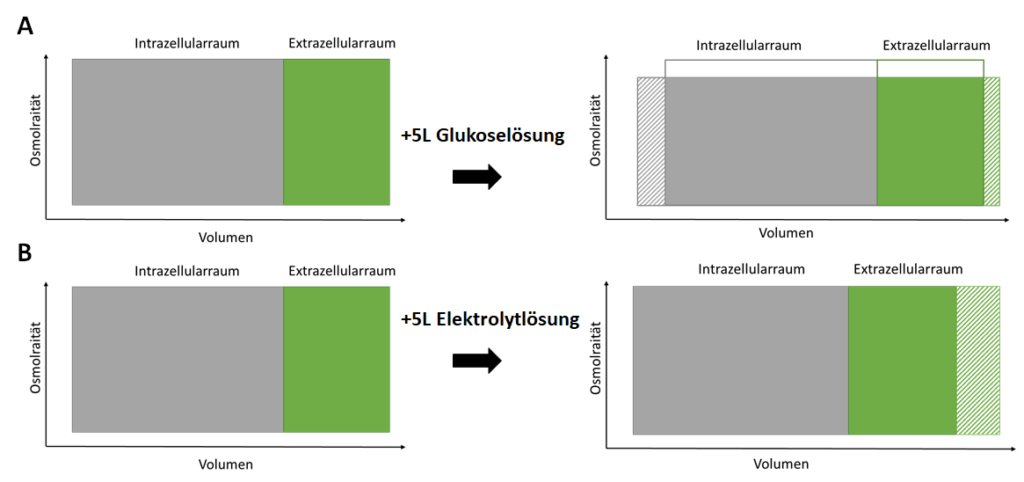
Man muss sich dabei aber vor Augen halten, dass sich freies Wasser anders als Vollelektrolytlösung gleichmäßig auf den Intra- und Extrazellulärraum verteilt (Abbildung 2). Nur die Expansion des Extrazellularraums führt aber zu Lungenödem, Pleuraergüssen, Aszites oder auch venöser Stauung.
Merke: Während 1 L Vollelektrolytlösung den Extrazellularraum auch um 1L vergrößert, vergrößert 1L freies Wasser ihn nur um 333 ml.
Falls jedwede Expansion des Extrazellulärraums vermieden werden soll, kann man das freie Wasser mit Furosemid kombinieren. Ferner sollte beim Einsatz von 5%-Glukose-Lösung beachtet werden, dass neben der Absenkung des Serumnatriums auch andere Elektrolyte, wie z.B. Kalium gesenkt werden können und dass durch die rasche Ausscheidung Therapieeffekte einer 5 % Glukose-Lösung evtl. nur von kurzfristiger Dauer sind.
Praktisch bietet sich ein abgestuftes Vorgehen an: Zunächst sollte man – nach der Adressierung der auslösenden Ursache – mit enteralem Wasser beginnen, wenn das nicht zu einem adäquatem Abfall des Natriums führt, kann man zu einer kontinuierlichen Glukoseinfusion übergehen.
Take home messages:
- Hyponatriämie unter Thiaziden wird durch eine Kombination von vermehrtem Trinken und verringerter Ausscheidung von freiem Wasser bei wahrscheinlich genetisch suszeptiblen Patient*innen ausgelöst. Bei der Mehrzahl der Patient*innen hat eine Thiazidtherapie keinen, bzw. kaum einen Einfluss auf das Plasmanatrium.
- Die einzige (kleine) klinische Studie konnte keine schnellere Natriumsenkung durch HCT bei Intensivpatient*innen im Vergleich zu Placebo feststellen.
- Therapeutisch steht die Adressierung der kausalen Faktoren im Vordergrund (Anpassung der Medikamente, Reduktion der Salzbelastung).
- Zum Ausgleich sollte freies Wasser vorzugsweise enteral gegeben werden, alternativ Glukoselösung (5%ig) intravenös. Der Bedarf an freiem Wasser sollte stets berechnet werden. Zur Vermeidung bzw. Ausgleich einer Volumenüberladung kann Wasser oder G5% Lösung mit Furosemid kombiniert werden.
- Freies Wasser verteilt sich anders als Elektrolytlösung nur zu 1/3 im extrazellularen Raum, sodass eine Volumenüberladung später auftritt.
Dieser Artikel wurde freundlicherweise reviewed durch Prof. Dr. Tobias Bergler, leitender Oberarzt der Abteilung für Nephrologie, Universitätsklinikum Regensburg.
Quellen:
1. Olsen MH, Møller M, Romano S, Andersson J, Mlodzinski E, Raines NH, Sherak R, Jeppesen AN. Association Between ICU-Acquired Hypernatremia and In-Hospital Mortality: Data From the Medical Information Mart for Intensive Care III and the Electronic ICU Collaborative Research Database. Critical Care Explorations. 2020;2(12):e0304. doi:10.1097/CCE.0000000000000304 Cited in: PubMed; PMID 33354677.
2. Friedman E, Shadel M, Halkin H, Farfel Z. Thiazide-induced hyponatremia. Reproducibility by single dose rechallenge and an analysis of pathogenesis. Annals of internal medicine. 1989;110(1):24–30. doi:10.7326/0003-4819-110-1-24 Cited in: PubMed; PMID 2491733.
3. Frenkel NJ, Vogt L, Rooij SE de, Trimpert C, Levi MM, Deen PMT, van den Born B-JH. Thiazide-induced hyponatraemia is associated with increased water intake and impaired urea-mediated water excretion at low plasma antidiuretic hormone and urine aquaporin-2. J Hypertens. 2015;33(3):627–33. doi:10.1097/HJH.0000000000000423 Cited in: PubMed; PMID 25426567.
4. Ware JS, Wain LV, Channavajjhala SK, Jackson VE, Edwards E, Lu R, Siew K, Jia W, Shrine N, Kinnear S, Jalland M, Henry AP, Clayton J, O’Shaughnessy KM, Tobin MD, Schuster VL, Cook S, Hall IP, Glover M. Phenotypic and pharmacogenetic evaluation of patients with thiazide-induced hyponatremia. J Clin Invest. 2017;127(9):3367–74. doi:10.1172/JCI89812 Cited in: PubMed; PMID 28783044.
5. Filippone EJ, Ruzieh M, Foy A. Thiazide-Associated Hyponatremia: Clinical Manifestations and Pathophysiology. American Journal of Kidney Diseases. 2020;75(2):256–64. doi:10.1053/j.ajkd.2019.07.011 Cited in: PubMed; PMID 31606239.
6. van IJzendoorn MMCO, Buter H, Kingma WP, Koopmans M, Navis G, Boerma EC. Hydrochlorothiazide in intensive care unit-acquired hypernatremia: A randomized controlled trial. Journal of critical care. 2017;38225–30. doi:10.1016/j.jcrc.2016.11.035 Cited in: PubMed; PMID 27984823.
7. Patel RB, Patel UR, Rogge MC, Shah VP, Prasad VK, Selen A, Welling PG. Bioavailability of hydrochlorothiazide from tablets and suspensions. J Pharm Sci. 1984;73(3):359–61. doi:10.1002/jps.2600730317 Cited in: PubMed; PMID 6716243.
8. Knauf H, Haase W, Mutschler E. Dosis-Wirkungs-Beziehungen von Xipamid bei gesunden Probanden [Dose-response relationship of xipamide in healthy subjects]. Arzneimittelforschung. 1980;30(9):1599–607. ger. Cited in: PubMed; PMID 7006620.
